
『 연소 』
》 연소란?
어떤 물질이 빛과 열을 내면서 타는 현상을 말합니다.
일반적으로 불이 붙어 타는 것을 모두 총칭합니다.
》 연소의 세 가지 조건
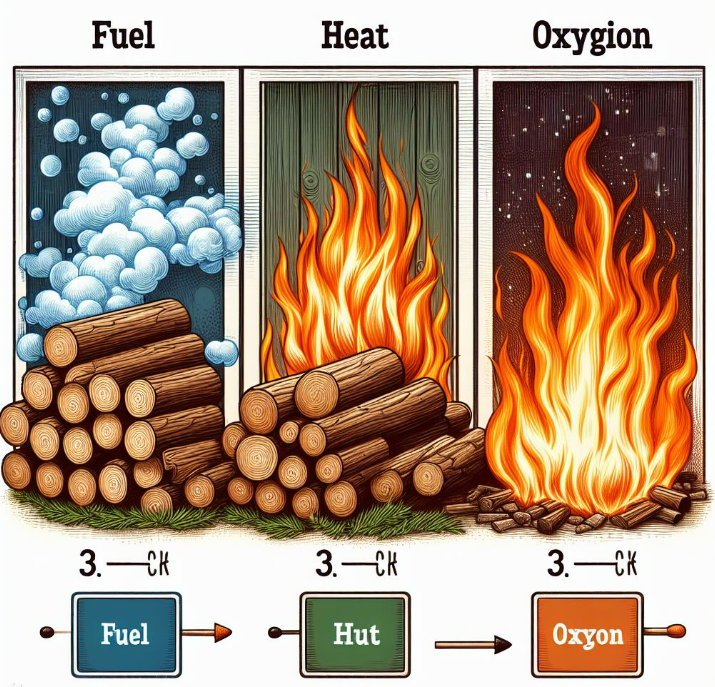
연소의 세 가지 조건은 다음과 같습니다
1. 연료(탈물질): 연소 반응에 참여하는 물질로, 일반적으로 공기 중에서 산소와 반응합니다.
2. 산소: 물질이 타기 위해서는 공기 중의 산소가 공급되어야 합니다.
3. 열(발화점): 연소 반응을 시작하고 유지하는 열이 필요합니다.
발화점에 도달해야 물질이 불에 타게 됩니다.
이 세 가지 요소가 함께 작용하여 불꽃이 타오르고, 빛과 열을 발생시킵니다.
》 소화란?
연소의 반대 개념으로 불을 끄는 것을 말합니다.
소화를 하기 위해서는 연소의 세 가지 조건 중 하나를 제거하면 됩니다.
온도를 낮추거나 산소를 차단시키고 탈 물질을 제거합니다.
온도를 낮추는 방법은 주로 물을 끼얹습니다.
산소를 차단하는 방법은 소화기를 사용, 모래 뿌리기, 이불을 이용해 공기차단하는 방법 등이 있습니다.

》 불꽃의 구분
1. 겉불꽃
양초나 알코올 등이 공기 중에서 연소할 때 불꽃의 가장 바깥쪽에 있는 불꽃으로, 불꽃(겉불꽃, 속불꽃, 불꽃심) 중에서 가장 온도가 높으며, 산소의 공급이 충분하므로 완전연소가 이루어집니다.
겉불꽃의 온도는 약 1400℃이고 불꽃의 색깔은 거의 볼 수 없으며, 산소가 충분하고 온도가 높으므로 다른 물질을 산화시키는 성질이 있어 산화 불꽃이라고 합니다.
예를 들면 어떤 물질을 촛불을 이용하여 연소시킬 때에는 겉불꽃 속에 넣어야 하며, 붉은색 구리 조각을 핀셋으로 집어 겉불꽃 속에 넣으면 구리가 산화되어 검은색의 산화구리가 생성됩니다.
양초의 심지에 불을 가까이 가져가면 불이 붙기까지 약간의 시간이 걸리는데, 이것은 심지에 스며든 고체 파라핀이 녹아서 액체가 되고 다시 기체가 되어 타기 시작하기 때문이며, 이 현상은 불이 타는 동안 계속됩니다.
즉, 양초의 연소 과정에서는 융해, 기화, 응고 등의 상태 변화가 일어나고 있습니다.
불꽃에는 겉불꽃 외에도 온도가 1200℃이며 가장 밝게 빛나는 속불꽃과 양초의 심지에 가까우며 어두운 부분인 불꽃심 등이 있습니다.
이 중 불꽃심은 심지를 타고 올라온 액체 파라핀이 불꽃으로 가열되어 기체로 되는 부분으로, 불꽃 중 가장 어두우며 온도는 400∼900℃입니다.
2. 속불꽃
속불꽃은 양초나 알코올 등이 공기 중에서 연소할 때 불꽃(겉불꽃, 속불꽃, 불꽃심) 중에서 겉불꽃에 의해 산소 공급이 차단되어 연소를 잘 못 하여 온도가 약 1200℃로 겉불꽃(1400℃)에 비해 약간 낮지만 가장 밝게 빛나는 불꽃입니다.
속불꽃은 완전히 타지 못한 탄소 알갱이가 산화되기 위해 다른 물질로부터 산소를 빼앗는 작용이 있어 환원 불꽃이라고도 합니다. 따라서 속불꽃은 금속 산화물의 환원에 이용될 수 있습니다.
예를 들면 구리 조각을 태웠을 때 생긴 검은색 산화구리(II) 조각을 속불꽃 속에 넣으면 속불꽃의 탄소 알갱이가 산화구리(II)의 산소를 빼앗아가므로 산화구리(II) 조각은 붉은색 구리로 환원됩니다(산화구리(II)의 환원 : ).
이때 탄소 알갱이는 산소와 결합하였으므로 산화되었고 산화구리(II)는 산소를 잃었으므로 환원되었으며, 탄소 알갱이는 환원제로 쓰인 것입니다.
양초와 마찬가지로 가스버너 등에서 가스를 태울 때도 불꽃심, 속불꽃, 겉불꽃으로 구분되는데, 속불꽃은 진한 청색을 띠고 겉불꽃은 연한 청색을 띱니다.
3. 불꽃심
기체가 불꽃을 내며 연소할 때 불꽃 중심부에 보이는 빛의 밝기가 약하고 온도가 비교적 낮은 부분으로 다소의 환원작용이 있는 부분입니다.
염심(焰心)이라고도 합니다.
양초의 불꽃 속이나 가스버너의 공기구멍을 막고 불을 붙였을 경우에 관찰할 수 있습니다.
불꽃심에서는 기화한 납(蠟)이나 도시가스가 속불꽃이나 겉불꽃에 의해 조금 가열되어 활성화되어 있기 때문에 다소 환원작용이 있습니다.
불꽃심 부분을 유리관 등으로 밖에 꺼내어 점화하면 연소합니다.
양초의 불꽃심 온도는 400℃에도 미치지 않습니다.
가스버너의 공기구멍을 열고 연소시키면 불꽃심은 없어집니다.
『 불꽃놀이 』

■ 불꽃놀이 ■
화약류를 연소·폭발시켰을 때 발하는 빛·불똥·불꽃·소리·연기를 이용하는 화공품(火工品)을 발사·폭발시켜 구경하는 놀이로 축제일·기념일 등에 많이 합니다.
여기에 사용하는 화공품을 연화(煙火)라고 하는데, 고대 인도·페르시아·그리스·로마 등에서 이미 그 착상이 있었다고 하며, 원형이 되는 횃불은 기원전부터 있었고 주로 신호로 사용되었습니다.
고대 중국에서 전쟁터의 신호 등으로 사용되었는데, 7세기 초 수(隋) 나라(隋) 양제(煬帝) 무렵부터 원시적인 연화가 있었다고 합니다.
13세기 화약이 발달하여 연화도 진보하여 그 세기말에는 이탈리아 피렌체에 전파되고, 15세기 무렵까지는 유럽 각지에 퍼졌으며 그 후 일반화되었습니다.
연화는 용법에 따라 크게 나누면 발사연화·장치연화·완구연화로 나누어집니다.

A. 발사연화
일반적 구조는 종이를 몇 장씩 겹쳐서 바른 공 모양의 옥피(玉皮) 중심에 흑색화약 등을 목화씨나 왕겨와 섞은 구슬을 놓고 할약(割藥)과 옥피 사이에 색화제(色火劑)·발연제(發煙劑)를 반죽하여 굳힌 작은 구슬 모양의 별을 채워 넣습니다.
점화선은 도화선을 옥피를 통하여 활약 속으로 끼운 것입니다. 이렇게 구성한 것을 할 물(割物)이라고(割物) 합니다.
철관·대나무통 바닥에 발사약으로 흑색화약을 채우고 그 위에 할 물을 놓고 발사약에 점화하면 할 물은 공중 높이 발사되고 동시에 점화선 끝에 불이 붙고 할 물이 적당한 높이까지 올라갔을 때 할 약이 작렬합니다.
A-1. 주간 발사용 연화
연기와 소리가 중요하며, 별을 넣는 곳에 연기가 되는 발연제를 넣어서 유색연기를 내게 합니다.
흰색은 석고·아연가루·산화아연 등, 노란색은 황·황화비소(계관석), 푸른색은 군청(群靑), 붉은색은 광명단(光明丹) 등이 사용됩니다. 또 아우라민(노란색)·파라나이트로아닐린(붉은색)·아이오딘(자색)·인디고(푸른색) 등을 첨가하여 아름다운 색조를 가진 연기를 내게 할 수 있습니다.
A-2. 야간발사용 연화에는 색화제(色火劑)로서 흑색화약 속에 질산바륨·질산스트론튬·염소산나트륨 등을 첨가하여 이것들이 연소할 때 불꽃반응을 이용하여 아름다운 불꽃을 감상할 수 있습니다.
또 불꽃제로 연화에 숯가루를 섞으면 불꽃이 꼬리를 끌며, 조명제(照明劑)로 마그네슘·철·알루미늄 가루 등을 첨가하면 각각 독특한 눈부신 빛을 내면서 연소합니다.
옥피를 튼튼히 만들면 할 약이 작렬할 때 큰 소리가 나는데, 과염소산나트륨·알루미늄 가루·삼황화안티모니 등의 혼합물을 발음제(發音劑)로 첨가하면 더 격렬한 작렬음이 발생합니다.
이 발음제를 보통 천둥이라고 합니다. 또 별의 수, 약제의 종류, 배치 등을 변화시키면 국화 모양이나 그 밖에 여러 모양의 아름다운 불꽃이 생깁니다.
별 틈에 낙하산이나 깃발을 넣어서 작렬할 때 높은 곳에서 떨어뜨리는 형식이 있는데 할 물과는 구별됩니다.
A-3. 장치연화는 큰 나무틀에 여러 모양으로 색화제·조명제·발연제 등을 철사 등으로 엮어 놓고 한쪽 끝에서 점화하면 서서히 타면서 퍼져 글씨·모양을 그려내는 것입니다.
알루미늄 가루 등의 불꽃가루를 다량으로 뿌리게 하여 폭포수가 떨어지는 모습을 그릴 수 있다고 합니다.
A-4. 완구연화는 철사나 대오리 끝에 흑색화약 조명제·색화제·불꽃제·발음제 등을 소량 붙인 것이나, 종이통에 발사약과 소형 할 물을 넣은 발사연화를 소형화시킨 것이 많습니다.
또 분사약을 종이에 싼 것은 폭죽이라 하며, 점화와 동시에 땅 위를 튀어다니다가 마지막에는 발음제에 점화하여 폭음을 내는 것이 있습니다.
A-5. 막대연화는 예전부터 있던 대표적 완구연화의 하나이며, 불꽃제로서 첨가한 숯가루가 황화칼륨과 적열화구(赤熱火球)를 만들어 여기에서 숯이 솔잎 모양으로 불꽃이 되어 나오는 것입니다.
연화는 화공품의 일종으로 위험방지를 위해 총포·도검·화약류 등 단속법(銃砲·刀劍·火藥類團束法: 1984.8.4. 법률 3743호)에 따라서 제조·저장·양도·소비가 규제되며, 보통 시판되는 완구연화라고 해서 함부로 해체·변형시키는 것은 위험하며, 취급할 때는 주의해야 합니다.
『 불꽃반응 』

■ 불꽃반응 ■
불꽃반응이란 어떤 물질을 겉불꽃 속에 넣었을 때 그 속에 포함된 원소에 따라 독특한 불꽃색을 나타내는 반응을 말하며
연소반응은 물질이 산소와 결합하여 다른 물질로 변하면서 열과 빛을 내는 현상을 말합니다.
배합제 내에 있는 금속원소가 어떤 것이냐에 따라 불꽃의 색이 결정되고 이 배합제가 연소반응을 일으키면서 강렬한 빛을 내며 하늘을 수놓았다가 사라지게 됩니다. 그리고. 같은 금속 원소를 포함하고 있으면 종류가 다른 화합물이라도 같은 불꽃색을 나타냅니다.
예를 들면 염화나트륨과 질산나트륨, 금속 나트륨 등은 모두 노란색의 불꽃색을 나타낸다. 그러나 모든 원소가 불꽃색을 나타내는 것은 아니며, 특정한 금속 원소만 불꽃색을 나타냅니다.
불꽃반응색이 비슷한 경우에는 나오는 빛을 분광기를 통해 선스펙트럼을 비교하면 서로 구별할 수 있습니다.
예를 들면 리튬(Li)의 불꽃색은 붉은색이고 스트론튬(Sr)의 불꽃색은 진한 붉은색으로 눈으로는 구별하기 어려운데, 이 경우 두 원소의 선스펙트럼을 비교하면 서로 구별해 낼 수 있습니다.
이러한 선스펙트럼 분석은 물질의 양이 매우 적어도 가능하고, 방법이 비교적 간단하며, 불꽃색이 매우 비슷한 원소도 쉽게 구별할 수 있다는 장점이 있습니다.
알칼리금속이나 알칼리토금속의 성분을 포함하는 물질을 겉불꽃에 넣으면 특유의 불꽃색이 나타나며 이를 불꽃반응이라 말하며, 불꽃놀이, 시료의 성분확인 등에 이용되며 금속을 구분하는 선스펙트럼에도 이용됩니다.
불꽃반응나트륨, 리튬, 칼륨, 칼슘, 스트론튬, 바륨, 구리 등 겉불꽃 속에서 나트륨은 노란색을, 리튬은 빨간색, 칼륨은 보라색을 나타내는 등 특유의 색을 나타냅니다.
'방과 후 수업 > 과학이야기' 카테고리의 다른 글
| 분자요리 (5) | 2024.10.21 |
|---|---|
| 아인슈타인 이야기 (2) | 2024.06.07 |
| 계영배_가득 차지 않는 잔(사이펀 원리) (0) | 2024.05.15 |
| 전자신호등-실험과학 (0) | 2024.05.14 |
| 필름통 건전지 만들기 (0) | 2024.05.13 |




댓글